Tormenta inflamatoria y COVID-19

AUTOR: Dr. Antonio Cano Ortiz
CONCEPTOS CLAVE:
- La tormenta inflamatoria es frecuente encontrarla en los pacientes con COVID-19.
- La detección precoz del estado de hiper-inflamación a través de la monitorización de citoquinas puede favorecer el abordaje precoz en los pacientes con COVID-19 que van a evolucionar de forma no favorable.
- Los marcadores de inflamación más útiles en la actualidad son la IL-6, dímero D y ferritina.
- Tratamientos inmunosupresores que contrarrestan el estado de hiper-inflamación son utilizados en la actualidad para minimizar la tormenta inflamatoria de estos pacientes.
La evidencia actual sugiere que algunos pacientes infectados por COVID-19 podrían responder con una tormenta citoquímica con características similares a una sepsis bacteriana o síndrome hemofagocítico/linfohistiocitosis. Esta progresión podría explicar el fenómeno clínico por el cual los pacientes están relativamente estables durante varios días, pero de repente sufren un deterioro cuando entran en el estadío de inmunidad adaptativa. (Young 3/3/2020). La existencia de predictores de mal pronóstico podrían ser útiles para detectar los pacientes que requerirían una atención individualizada y una terapia dirigida y precoz.
1. FACTORES DE RIESGO
Entre los pacientes hospitalizados
• ~10-20% requieren UCI
• ~3-10% requieren intubación
• ~2-5% fallecen
1.1. Estratificación de riesgo por antecedentes previos
Los números absolutos pueden variar pero el impacto relativo de varios factores de riesgo persiste en la series (edad avanzada, sexo masculino, comorbilidades, enfermedad pulmonar crónica, enfermedad cardiovascular incluyendo hipertensión y enfermedad coronaria, enfermedad cerebrovascular y diabetes).
En el estudio de Ruan, la distribución del tiempo de supervivencia desde el inicio de la enfermedad al fallecimiento, mostraba 2 picos con el primer pico aproximadamente a los 14 días y el segundo pico aproximadamente a los 22 días.
Entre los 68 fallecimientos, 36 pacientes (53%) murieron por fallo respiratorio, 5 pacientes (7%) por fallo circulatorio por daño miocárdico, 22 pacientes (33%) de ambas causas y 5 murieron de causa desconocida. Basándose en el análisis de los datos, se confirma la muerte de algunos pacientes por miocarditis fulminante (Ruan, 2020).
1.2. Estratificación de riesgo por datos de laboratorio Ruan 3/3/20, Xie et al. 2020, Wang et al. 2020.)
• Alteración en el recuento hematológico:
• Linfopenia y su tendencia en el tiempo (prolongación o empeoramiento implica peor pronóstico)(Chu et al. 2004) Con una distorsión en la distribución de linfocitos CD4 y CD8 (Cossarizza A 2020)
• Ratio de Neutrófilos/Linfocitos aparece como un marcador pronóstico
(Liu et al. pre-print). El ratio plaquetas/linfocitos también se ha visto que se asocia a la presencia de tormenta citoquímica (Qu R 2020)
• Niveles elevados de PCR
Los predictores de fatalidad de un reciente estudio retrospectivo, multicéntrico de 150 pacientes con confirmación de COVID-19 en Wuhan, China, incluyeron elevación de ferritina (media 1297,6 ng/ml en no supervivientes vs 614,0 ng/ml en supervivientes; p<0,001) and IL-6 > 7 (p<0,0001), sugeriendo que la mayor mortalidad podría ser conducida a través de la hiperinflamación. Otros parámetros clínicos y analíticos que muestran diferencias significativos entres los pacientes ingresados en UCI versus no UCI son: Frecuencia respiratoria superior a 24 resp/min, Linfocitos inferiores a 1 x 10 9, Tiempo de protrombina superior a 12 seg, Dimero D (mg/dl) superior a 2.4 , Albumina (g/L) inferior a 30 , ALT y ALT (U/L) superior a 40, LDH (U/L) superior a 248, ferritina superior a 800, saturación al ingreso <905 (Huang, 2020; Nashan Chen, 2020)
Estudios previos han sugerido que la linfopenia y la tormenta citoquímica son alteraciones típicas en la infecciónes causadas por coronaviurs con elevada patogenicidad tales como
SARS and MERS (Gupta KK 2014, Lucena-Silva N 2016, Rose-John S 2017,Tanaka T 2014)
Así, el descenso en el contaje de linfocitos y el aumento de citoquinas inflamatarias en sangre periférica ha sido reportado en infección por COVID-19 (Huang C 2020, Liu J, 2020, Magnan 1996)
Dada la rápida expasión y la alta mortalidad, un mejor conocimiento de las características clínics es mandatorio para poder llevar a cabo un screeining de marcadores de inflamación y ser monitorizados en el curso de la enfermedad. (Gupta KK 2020, Lucena-Silva N 2016,. Yiu HH 2012)
Metha et al, proponen que en todos los pacientes con infección severa por COVID-19 deberían ser descartado el estado de hiperinflamación a través de marcadores de laboratorio (aumento de ferritina, descenso de plaquetas, aumento de VSG and the HScore (Fardet L 2014) para identificar el subgrupo de pacientes que prodrían beneficiarse de la inmunosupresión y podría descender la mortalidad. Opciones terapeúticas como corticoides, inmnoglobulinas o bloqueadores de interleucinas (tocilizumab o anakinra) e inhibidores de la JAK son posibles en estas situaciones de hiperinflamaación.(Mehta P et al. Correspondence COVID-19)
1.3 Scores utilizados hasta el momento como predictores de gravedad
1.3.1 q SOFA (quickSOFA): Validado para sepsis
– Estado mental alterado; TAS <100 mmHg; Frecuencia respiratoria >21 rpm (2 de 3 criterios se asocian a peor resultado en sepsis)
1.3.2 MulBSTA score
-Infiltrado multilobar: 5; Linfocitos totales < 800 :4; Infección bacteriana concurrente: 4; Fumador activo: 3; Exfumador:2; Hipertensión: 2; Edad > 60 años: 2
(Mortalidad: Entre 8 y 11 puntos: 5-11% y >12 puntos: 15,9%)
2. PATRÓN INFLAMATORIO EN COVID-19
Estudios han demostrado que en la patogénesis de SARS, ocurre una tormenta inflamatoria que produce una considerable liberación de citoquinas proinflamatorias incluyendo (IL -6, TNF-α e IL-12) (Li Y 2013)
Al igual que los cambios producidos en SARS y MERS, en COVID-19, existen elevados niveles de citoquinas en plasma incluyendo IL-6, IL-2, IL-7, IL-10, G-CSF, IP10, MCP1, MIP1A y TNF-α que han sido detectados en pacientes ingresados en UCI. (Chen N 2020, Huang C 2020) y se realacionan con la severidad y pronóstico de la enfermedad. En la biopsia de muestras de la autopsia de un paciente que moría por infección severa por COVID-19, los análisis histológicos muestran una afectación alveolar difusa con exudado fibromixoide, con infiltrado linfocitario mononuclear en ambos pulmones. (Xu Z 2020).
Ambos, GM-CSF e IL-6 son las principales citoquinas que apoyan la tormenta inflamatoria que podría dar lugar a una disfunción en el intercambio alveolo-capilar, alterando la difusión, produciendo fibrosis pulmonar y fallo orgánico. (Zhou Y 2020). Estudios sugieren que la IL-6 podría jugar un papel fundamental en la tormenta citoquímica. (Davies R 2014, Wolf J 2011, Kaly L 2012).
Tao Liu, et al estudiaron un total de 69 pacientes graves infectados por COVID-19 comparados con pacientes sin afectación severa, valorando los parámetros inmunológicos y citoquinas. Detectaron una variación leve en IL-2, IL-4, IL-10, TNF-a, IFN-γ antes y después de tratamiento. La elevación de PCR, ferritina, IL-6 y LDH fueron asociados con requerimiento de un tratamiento más intensivo y prolongado el cual incluía corticoides, inmunoglobulinas, antibíoticos, oxigenoterapia y ventilación mecánica. Este hecho muestra que dichos parámetros analíticos están relacionados con la severidad de la enfermedad. Otros estudios mostraron que cambios en la IL-6 estaban relacionados con la enfermedad, sugeriendo que la IL-6 podría ser una herramienta útil en la monitoriación de la enfermedad severa por COVID-19. (Liu 2020).
3. ESTRATICACIÓN DE ENFERMEDAD
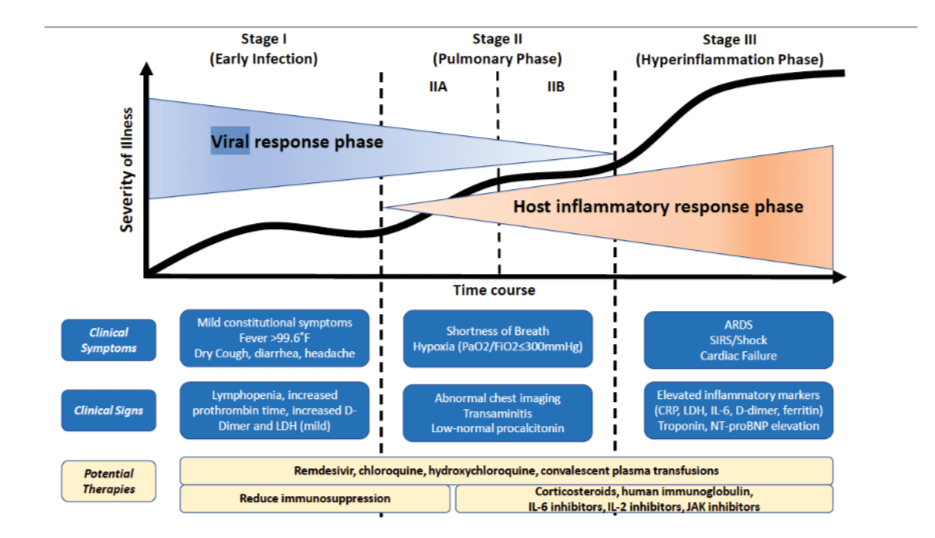
Es imperativo un abordaje estructurado al fenotipo clínico para distinguir en la fase en donde la patogenicidad viral es dominante frente a la respuesta inflamatoria del huésped. Hasan K et al, proponen un sistema de estadificación clínica para establecer una nomenclatura estandarizada para la evaluación uniforme y la notificación de esta enfermedad, para facilitar la aplicación terapéutica y evaluar la respuesta. Proponen el uso de un sistema de clasificación de 3 etapas, reconociendo que la enfermedad COVID-19 exhibe tres grados de gravedad creciente que se corresponden con hallazgos clínicos distintos, respuesta a la terapia y resultado clínico (Figura 1)
Estadio I
El diagnóstico en esta etapa incluye PCR de muestra respiratoria, pruebas de suero para IgG e IgM de SARS-CoV-2, junto con imágenes de tórax, recuento sanguíneo completo y pruebas de función hepática. La analítica puede revelar linfopenia y neutrofilia sin otras anormalidades significativas.
Estadio II
Durante esta etapa, los pacientes desarrollan una neumonía viral, con tos, fiebre y posiblemente hipoxia (definida como una PaO2 / FiO2 de <300 mmHg). Las imágenes con radiografía de tórax o tomografía computarizada revelan infiltrados bilaterales u opacidades en vidrio esmerilado. El análisis de sangre revela un aumento de la linfopenia, junto con el aumento de transaminasas. Los marcadores de inflamación sistémica pueden estar elevados, pero no notablemente. Es en esta etapa cuando la mayoría de los pacientes con COVID-19 necesitarían ser hospitalizados para una observación y tratamiento cercano.
Etapa IIa (sin hipoxia) y Etapa IIb (con hipoxia).
Estadio III
La infección por COVID-19 produce una disminución en los recuentos de células T auxiliares, supresoras y reguladoras. Varios estudios han demostrado que las citocinas inflamatorias y los biomarcadores como la interleucinas (IL-2, IL-6, IL-7), factor estimulante de colonias de granulocitos, la proteína inflamatoria de macrófagos 1-α, el factor de necrosis tumoral α, la proteína C reactiva, la ferritina y el dímero D están significativamente elevados en aquellos pacientes con enfermedad más grave.Troponina y péptido natriurético de tipo B N-terminal (NT- proBNP) también puede ser elevado. Una forma similar a la linfohistiocitosis hemofagocítica (sHLH) puede ocurrir en los pacientes en esta etapa avanzada de la enfermedad. En esta etapa, se pueden detectar shock, espasmos vasculares, insuficiencia respiratoria e incluso colapso cardiopulmonar. La afectación de los órganos sistémicos, incluso la miocarditis, se manifestarían durante esta etapa. La terapia personalizada en la etapa III depende del uso de agentes inmunomoduladores para reducir la inflamación sistémica antes de que el paciente termine en disfunción multiorgánica. En esta fase, el uso de corticosteroides puede justificarse en concierto con el uso de inhibidores de citoquinas como tocilizumab (inhibidor de IL-6) o anakinra (antagonista del receptor de IL-1). La inmunoglobulina intravenosa (IGIV) también puede desempeñar un papel en la modulación de un sistema inmune que se encuentra en un estado hiperinflamatorio. En general, el pronóstico y la recuperación de esta etapa crítica de la enfermedad es pobre, y el rápido reconocimiento y despliegue de dicha terapia podría tener mejor rendimiento.
BIBLIOGRAFÍA
- Cossarizza A, De Biasi S, Guaraldi G, Girardis M, Mussini C; Modena.SARS-CoV- 2, the Virus that Causes COVID-19: Cytometry and the New Challenge for Global Health.Covid-19 Working Group (MoCo19)Cytometry A. 2020 Mar 18.
- QuR2020LingY,ZhangYH,WeiLY,ChenX,LiX,LiuXY,LiuHM,GuoZ,RenH, Wang Q. Platelet-to-lymphocyte ratio is associated with prognosis in patients with Corona Virus Disease-19. J Med Virol. 2020
- Zhongliang Wang, MD, Bohan Yang, MD, Qianwen Li, MD, Lu Wen, MD, Ruiguang Zhang, MD, Clinical Features of 69 Cases with Coronavirus Disease 2019 in Wuhan, China, Clinical Infectious Diseases, 2020.
- Huang C et. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (2020)
- Gupta KK, Khan MA, Singh SK. Constitutive Inflammatory Cytokine Storm: A Major Threat to Human Health. Journal of Interferon & Cytokine Research 2020;40(1):19-23.
- Lucena-Silva N, Torres LC, Luna CF, et al. The balance between the serum levels of IL-6 and IL-10 cytokines discriminates mild and severe acute pneumonia. BMC pulmonary medicine 2016;16(1):170.
- Rose-John S, Winthrop K, Calabrese L. The role of IL-6 in host defence against infections: immunobiology and clinical implications. Nature Reviews Rheumatology 2017;13(7):399.
- Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease. Cold Spring Harbor perspectives in biology 2014;6(10):a016295)
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 2020;395(10223):497-506.
- Liu J, Li S, Liu J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. 2020.
- Magnan A, Mege J-L, Escallier J-C, et al. Balance between alveolar macrophage IL- 6 and TGF-beta in lung-transplant recipients. Marseille and Montréal Lung Transplantation Group. American journal of respiratory and critical care medicine 1996;153(4):1431-36)
- Yiu HH, Graham AL, Stengel RF. Dynamics of a cytokine storm. PloS one 2012;7(10)
- Fardet L,Galicier L, Lambotte O, et al. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol 2014; 66: 2613–20)
- Mehta P et al. Correspondence COVID-19) : consider cytokine storm syndromes and. The Lancet, 6736(20), 19–20).
- Li Y, Chen M, Cao H, Zhu Y, Zheng J, Zhou H. Extraordinary GU-rich single-strand RNA identified from SARS coronavirus contributes an excessive innate immune response. Microbes Infect 2013;15 :88-95
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395(10223):507-513.
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497-506
- Xu Z 2020, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute acute respiratory distress syndrome. Lancet Respir Med 2020; Published Online February 17. DOI:https://doi.org/10.1016/S2213-2600(20)30076-X
- Zhou Y, Fu B, Zheng X, et al. Aberrant pathogenic GM-CSF+ T cells and inflammatory CD14+ CD16+ monocytes in severe pulmonary syndrome patients of a new coronavirus. BioRxiv 2020:2020.02.12.945576. DOI: https://doi.org/10.1101/2020.02.12.945576
- Davies R, Choy E. Clinical experience of IL-6 blockade in rheumatic diseases – implications on IL-6 biology and disease pathogenesis. Semin Immunol 2014;26 :97- 104.
- Wolf J, Rose-John S, Garbers C. Interleukin-6 and its receptors: a highly regulated and dynamic system. Cytokine 2014;70 :11-20.
- Jones SA, Scheller J, Rose-John S. Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling. J Clin Invest 2011;121 :3375-83. Kaly L, Rosner I. Tocilizumab – a novel therapy for non-organ-specific autoimmune diseases. Best Pract Res Clin Rheumatol 2012;26 :157-65
- Liu 2020, Tao and Zhang, Jieying and Yang, Yuhui and Zhang, Liling and Ma, Hong and Li, Zhengyu and Zhang, Jiaoyue and Cheng, Ji and Zhang, Xiaoyun and Wu, Gang and Yi, Jianhua, The Potential Role of IL-6 in Monitoring Coronavirus Disease 2019 (3/1/2020). Available at SSRN: https://ssrn.com/abstract=3548761)